起搏器通道的发现可能会带来更好的心脏药物
WeillCornellMedicine研究人员的一项研究揭示了称为脂质的脂肪相关分子调节起搏器离子通道蛋白的机制,这些蛋白有助于控制心律。
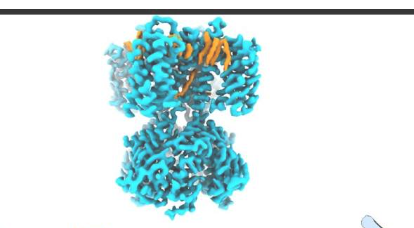
在11月9日发表在NatureStructural&MolecularBiology上的这项研究中,研究人员使用了包括低温电子显微镜(cryo-EM)在内的先进方法,以高分辨率详细展示了某些脂质如何与起搏器离子通道相互作用以增强其活性。原则上,用药物调节这种脂质相互作用可能是治疗心律失常和其他疾病的好策略。
“众所周知,离子通道很难被药物靶向,因为识别特定通道特异性的药物结合位点存在挑战,但这项工作揭示了可能具有高度特异性的位点,因此是可行的药物靶点,”资深作者Dr.威尔康奈尔医学院麻醉学生理学和生物物理学教授CrinaNimigean。
该研究的第一作者是PhilippSchmidpeter博士,他是WeillCornellMedicine麻醉学系Nimigean实验室的研究助理。
离子通道是位于细胞膜内的管状蛋白质结构,能够促进和调节钾、钠和其他电解质的带电分子流入和流出细胞。这些带电分子或离子流是细胞行为的关键决定因素。称为起搏器通道的专门离子通道对心脏细胞和神经元的节律活动特别重要。因此,准确了解这些起搏器通道的工作原理可以更好地治疗心律失常、慢性疼痛、癫痫和其他疾病。据估计,仅心律失常就会影响美国数百万人。
科学家们已经知道,细胞膜的主要成分脂质参与调节起搏器通道的活动。但他们对这些互动如何运作知之甚少。一般来说,研究脂质的方法不如研究蛋白质和其他生物分子的方法发达。此外,离子通道在嵌入细胞膜时发挥作用,细胞膜由两层薄薄的脂质组成,而细胞膜及其脂质成分很难以允许进行详细实验操作的方式复制。
博士。然而,Schmidpeter和Nimigean能够通过首先检查细菌起搏器通道SthK来获得关于脂质起搏器通道相互作用的重要线索。在之前的研究中,他们开发了一个用于研究SthK的实验平台,包括他们可以通过实验改变的类似膜的环境。他们说,SthK是人类中发现的起搏器通道(称为HCN通道)的有用模型,因为这两个通道尽管存在进化鸿沟,但仍有许多重要的相似之处。
SthK研究表明,两种脂质,磷脂酰甘油和心磷脂,可以通过破坏特定分子连接(称为盐桥)的方式与通道结合,这种连接通常倾向于关闭通道。当盐桥被脂质破坏时,通道变得更加开放和活跃。同样,通过其他方式去除盐桥会显着增加通道活性并消除这些脂质影响该活性的能力。
在HCN通道中发现了相同的盐桥,实验表明,在后者中,相同的脂质调节机制在起作用:去除盐桥对通道活性的影响与SthK实验中相同,尽管对于HCN通道来说,关键是脂质结合伴侣是一种不同的脂质,即磷脂酸。
实验包括与SthK结合的脂质的低温EM成像——该成像为未来药物如何破坏或增强这种脂质相互作用以调节起搏器通道功能提供线索。
研究人员希望在后续工作中能够阐明这种脂质起搏器相互作用在心律失常或癌症等异常情况中的作用。
“各种情况都会影响心脏和其他组织的脂质成分,因此看到这种起搏器机制在疾病中发生改变也就不足为奇了,”Schmidpeter博士说。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。










