进入线粒体膜的门
线粒体——负责人类细胞产生能量的细胞器——曾经是自由生命的有机体,在十亿多年前就进入了早期真核细胞。从那时起,它们在共生进化的经典例子中与宿主无缝融合,现在依靠宿主细胞核中制造的许多蛋白质来正常运作。
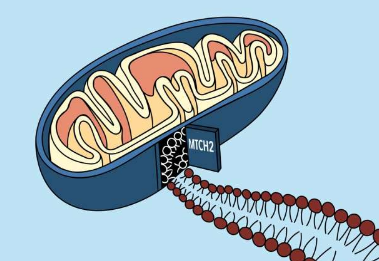
线粒体外膜上的蛋白质尤为重要;它们允许线粒体与细胞的其他部分交流,并在免疫功能和一种称为细胞凋亡的程序性细胞死亡中发挥作用。在进化过程中,细胞进化出一种特定的机制,通过该机制将这些在细胞质中产生的蛋白质插入线粒体膜。但这种机制是什么,以及涉及哪些细胞参与者,长期以来一直是个谜。
Whitehead研究所成员JonathanWeisan和加州理工学院教授RebeccaVoorhees实验室的一篇新论文为这个谜团提供了解决方案。这项工作于10月21日发表在《科学》杂志上,揭示了一种称为线粒体载体同源物2(简称MTCH2)的蛋白质,它与许多细胞过程甚至癌症和阿尔茨海默氏症等疾病有关,它负责充当“门”供多种蛋白质进入线粒体膜。
“直到现在,没有人知道MTCH2真正在做什么——他们只知道当你失去它时,所有这些不同的事情都会发生在细胞上,”同时也是麻省理工学院生物学教授和教授的Weisan说。霍华德休斯医学研究所研究员。“为什么这种蛋白质会影响这么多不同的过程有点神秘。这项研究为理解为什么MTCH2与阿尔茨海默氏症和脂质生物合成以及线粒体裂变和融合有关:因为它负责插入所有这些不同的类型膜中的蛋白质。”
“我们实验室之间的合作对于理解这种相互作用的生物化学至关重要,并导致对细胞生物学中一个基本问题的真正令人兴奋的新理解,”Voorhees说。
寻找一扇门
为了找出细胞质中的蛋白质——特别是一种称为尾锚定蛋白的蛋白质——是如何入线粒体外膜的,怀特黑德实验室的博士后研究员和该研究的第一作者AlinaGuna以及Voorhees实验室的研究生TaylorStevens和博士后AlisonInglis决定使用一种称为使用CRISPR干扰(或CRISPRi)筛选方法的技术,该方法由Weisan及其合作者发明。
“CRISPR筛选让我们系统地去除了每一个基因,然后观察并观察[一种特定的尾锚蛋白]发生了什么,”Guna说。“我们发现了一个基因,MTCH2,当我们摆脱它时,我们的蛋白质进入线粒体膜的数量大大减少。所以我们想,也许这就是进入的大门。”
为了确认MTCH2是进入线粒体膜的门户,研究人员进行了额外的实验,以观察当MTCH2不存在于细胞中时会发生什么。他们发现MTCH2既是必要的,也是充分的,可以让尾锚定膜蛋白从细胞质移动到线粒体膜。
MTCH2将蛋白质从细胞质转运到线粒体膜的能力可能是由于其特殊的形状。研究人员通过AlphaFold运行该蛋白质的序列,这是一种通过氨基酸序列预测蛋白质结构的人工智能系统,结果表明它是一种疏水性蛋白质——非常适合插入油膜中——但只有一个亲水槽,而其他的蛋白质可以进入。
“它基本上就像一个漏斗,”古纳说。“蛋白质来自细胞质,它们滑入亲水槽,然后从蛋白质移动到膜中。”
为了证实这个凹槽对蛋白质的功能很重要,Guna和她的同事设计了另一个实验。“我们想玩弄这个结构,看看我们是否可以改变它的行为,我们能够做到这一点,”古纳说。“我们进入并进行了单点突变,该点突变足以真正改变蛋白质的行为方式以及它与底物的相互作用方式。然后我们继续发现使其活性降低的突变和使其变得超级的突变积极的。”
这项新研究的应用超出了回答线粒体研究的基本问题。“由此产生了很多东西,”古纳说。
一方面,MTCH2插入了一种称为细胞凋亡的程序性细胞死亡的关键蛋白质,研究人员可能会利用这种蛋白质治疗癌症。“我们可以通过赋予白血病细胞改变MTCH2活性的突变来使白血病细胞对癌症治疗更加敏感,”古纳说。“这种突变使MTCH2的行为更加‘贪婪’,并将更多的东西插入细胞膜,其中一些插入的东西就像促凋亡因子,所以这些细胞更有可能死亡,这在癌症的背景下是非常棒的治疗。”
这项工作还提出了关于MTCH2如何随着时间的推移发展其功能的问题。MTCH2是从一个称为溶质载体的蛋白质家族进化而来的,它可以在细胞膜上穿梭各种物质。“我们对这个进化问题非常感兴趣,你如何从一种古老的、无处不在的蛋白质中进化出新的功能?”魏斯曼说。
研究人员仍然需要了解线粒体如何与细胞其他部分相互作用,包括它们如何对细胞内的压力和变化作出反应,以及蛋白质如何首先找到进入线粒体的途径。“我认为[这篇论文]只是第一步,”韦斯曼说。“这只适用于一类膜蛋白——它并没有告诉你蛋白质在细胞质中产生后发生的所有步骤。例如,它们是如何被运送到线粒体的?所以请继续关注——我认为我们我们将了解到我们现在有一个非常好的系统来打开这一细胞生物学的基本部分。”
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。










