一项电子显微镜研究揭示了肌动蛋白丝极性的奥秘
肌动蛋白丝——对从单细胞到动物的生命运动至关重要的蛋白质结构——长期以来一直被认为具有与其物理特征相关的极性,具有生长的“倒刺”末端和收缩的“尖”末端。细丝的末端与细胞中其他蛋白质相互作用的方式也不同。然而,决定这些差异的机制从未被科学家们完全弄清楚。现在,宾夕法尼亚大学佩雷尔曼医学院的研究人员通过使用一种称为低温电子显微镜(cryo-EM)的技术揭示了肌动蛋白丝末端的关键原子结构。
这项发表在《科学》杂志上的研究提供了基本的见解,可能有助于填补影响某些肌肉、骨骼、心脏、神经和免疫系统疾病的细节,这些疾病是由肌动蛋白缺陷或缺陷引起的。
肌动蛋白是高等生物(例如动物)细胞内最丰富的蛋白质。它作为称为细丝的细长结构的基石,作为细胞“细胞骨架”的一部分提供关键的结构支持,该系统赋予细胞形状和极性。肌动蛋白丝的快速变化是关键细胞事件的基础,例如沿表面移动、细胞间接触和细胞分裂。肌动蛋白丝也是肌纤维的主要成分。
“我们的研究结果提供了对我们已知40多年的过程的机制理解,称为长丝跑步机,并影响我们如何看待肌动蛋白在健康和疾病中的细胞作用,”该研究的资深作者说RobertoDominguez博士,宾夕法尼亚大学WilliamMaulMeasey生理学总统教授。
肌动蛋白丝的动力学主要由“跑步机”过程控制,通过该过程,单个肌动蛋白从一个细丝末端(称为尖端)脱落,并添加到另一个带倒刺的末端。肌动蛋白丝可以通过不同的所谓“加帽”蛋白来稳定,这些蛋白结合到丝端以阻止单个肌动蛋白的进一步添加或丢失。许多其他蛋白质也与肌动蛋白丝的倒刺和尖端结合。但是决定这些相互作用特异性的结构细节——解释为什么这两个末端的功能如此不同的细节——一直是模糊的。
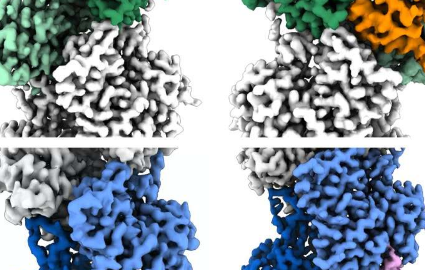
在他们的研究中,包括两名宾夕法尼亚大学学生在内的研究人员——Dominguez实验室最近的研究生PeterCarman博士,以及目前在实验室的研究生KyleBarrie博士,他们共同担任第一作者-使用低温EM分析了肌动蛋白丝。使用这种高分辨率成像技术,研究人员可以获得目标分子的数千张快照,通过计算对齐它们,然后对它们进行平均以减少随机图像“噪声”——产生可能足够清晰以可视化的分子3D重建单个原子。
在人工智能(AI)的帮助下,研究人员能够将注意力集中在细丝的末端而不是它们的中间,这在以前的类似研究中是常态。通过这样做,他们确定了数十万个灯丝端视图,使他们能够获得近原子尺度的重建。这些揭示了在未加盖的倒刺端处的“扁平”肌动蛋白形状或构象,而在未加盖的尖端处是“扭曲”的构象。
数据还详细说明了由两种肌动蛋白丝帽蛋白诱导的结构变化,CapZ位于倒钩端,而tropomodulin位于尖端。这是在骨骼肌和心肌细丝末端发现的两种蛋白质,在稳定肌纤维中肌动蛋白丝方面发挥着重要作用,如果没有这些蛋白质,我们的肌肉就会分崩离析。
这项研究的结果为更深入地了解整个肌动蛋白生物学提供了重要的机制细节。研究人员认为,这些研究见解也应该有助于理解和最终治疗由肌动蛋白功能障碍引起的疾病。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。










