研究人员对胰腺癌中的活体药物反应和耐药口袋进行成像
由于Garvan研究所开发的研究工具,胰腺癌药物的反应和耐药性已经以前所未有的细节被发现。
在胰腺癌中通常过度活跃的关键癌症驱动分子的实时显微镜镜头可用于揭示通过联合疗法解决耐药性的新途径。
Garvan医学研究所的研究小组发现,导致癌细胞繁殖和扩散的分子AKT在肿瘤的不同部位被激活,包括在扩散的癌症的边界和低氧供应区域,AKT形成对治疗的抵抗力。
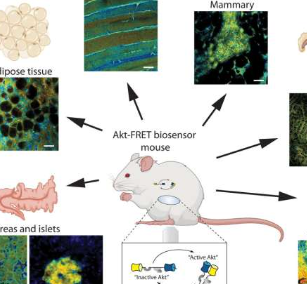
这项研究是通过Garvan开发的“生物传感器”小鼠模型实现的,该模型产生AKT的荧光版本,并提供活组织内主要癌细胞信号网络的第一个实时视图。
“AKT途径几十年来一直是治疗的目标,但迄今为止,仅针对该途径的药物在临床上基本上无效,”入侵与转移实验室负责人,Garvan癌症生态系统项目联合负责人PaulTimpson教授说。
“由于我们新的成像模型,我们可以看到组合方法如何降低耐药性,关闭AKT并帮助阻止肿瘤生长和扩散的明确方向。这项研究可以帮助显着改善胰腺癌患者的预后。
该研究发表在《科学进展》杂志上。
胰腺癌的五年生存率不到11%,一旦癌症转移,这一比率会进一步下降。因此,迫切需要改进这种侵袭性癌症的治疗。
一个有希望的治疗靶点是AKT通路-一种关键的信号通路,在整个身体的常规细胞中维持正常的细胞生长和新陈代谢。许多癌症,包括大约四分之一的胰腺癌,携带这种途径的改变版本,过度活跃并加速癌症的生长和扩散。
“我们的生物传感器鼠标是第一个能够向我们准确显示AKT在活组织中何时何地打开或关闭的工具,为我们提供了前所未有的治疗反应和抵抗力视图,”Timpson教授说。
“使用ACRFINCITe中心的活体显微镜对我们的生物传感器模型进行成像,我们使用临床治疗阻断AKT活动,但可以实时看到AKT在耐药口袋内保持打开状态,特别是在靠近侵入性边界或氧气供应不足的区域,”共同资深作者,VIB-KULeuven癌症生物学中心活体成像专家中心负责人,Garvan访问科学家MaxNobis博士说。
“我们还看到,随着癌细胞靠近血管,AKT开始激活。这表明AKT不仅驱动癌症生长,而且还积极推动癌症扩散到身体其他部位的早期事件。我们第一次能够在活胰腺中看到这些事件。
“现在我们可以可视化治疗反应和耐药性,我们的下一步将是研究共同靶向AKT的治疗方法与打开血管以改善药物输送的药物相结合,同时打破已知的障碍,如通常围绕胰腺肿瘤的致密纤维化组织。这可以改善药物输送,并在难以穿透的口袋内关闭AKT,以帮助减少耐药性。在肿瘤内实时看到这种组合方法对于改善治疗至关重要,“Nobis博士说。
研究人员表示,他们的生物传感器模型接下来将用于优化AKT通路抑制剂针对胰腺癌和其他AKT驱动癌症的新联合疗法。
“我们在癌细胞中看到AKT的能力消除了新疗法开发中的猜测,并具有广泛的应用,AKT有助于许多癌症,包括乳腺癌和前列腺癌。我们的模型是精准医学中共同靶向肿瘤生态系统时代的重要新工具,使我们更接近改善患者的治疗选择,“Timpson教授说。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。










