用mRNA开关建立哺乳动物细胞内计算的基础
HirohideSaito教授和他的研究团队开发了一种使用Cas蛋白控制mRNA翻译的新方法,从而扩大了mRNA开关的种类,并使在哺乳动物细胞中构建合成基因回路变得更加容易。这项研究的结果于2023年4月19日发表在NatureCommunications上。
合成生物学领域正在探索能够像计算机一样精确控制细胞功能和命运的细胞计算技术。通过根据需要对基因表达模式进行编程,研究人员可以极大地加深我们对各种生物过程的理解并创造新的医学治疗方法。未来,这项技术将有助于在药物发现、疫苗开发、细胞移植和其他形式的医学治疗中提高疗效并减少副作用。
为了创建这种精确的控制系统,有必要在活细胞中构建像计算机一样处理信息的复杂电路,这反过来又需要使用基于生命系统构建模块的人工遗传电路,如DNA、RNA、和蛋白质。然而,可由科学家修改以控制的组件的可用性一直是精确编程细胞行为的限制因素。
最近,研究人员开始利用RNA结合蛋白(RBP)作为翻译调节剂的力量。然而,这种方法受到数量有限的能够调节翻译的限制性商业惯例的阻碍,特别是那些具有多重兼容性的限制性商业惯例,无法完全起飞构建用于基础研究和临床应用的转录后合成生物电路。
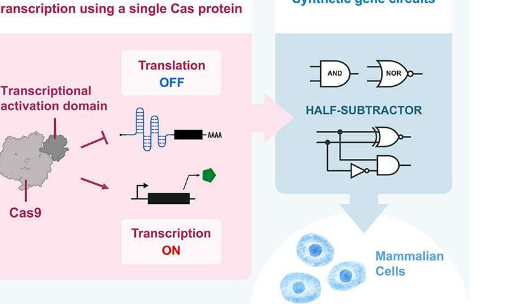
为了延长可用作翻译调节剂的RBP列表,Saito和他的团队利用CRISPR-Cas蛋白的能力,通过将它们插入目标mRNA的5'-UTR(非翻译区)来识别特定的sgRNA(单向导RNA)序列编码报告基因产物(开关)。
在没有相应的Cas蛋白(触发)的情况下,报告基因产物会在没有对抗的情况下进行翻译,这意味着开关处于开启状态。然而,如果细胞表达Cas蛋白,它会通过sgRNA序列与目标mRNA结合并阻断报告基因产物的翻译,从而将开关切换到关闭状态(关闭开关:开启状态→关闭状态)。通过将所谓的“开关逆变器”模块整合到系统中,团队可以将这些OFF开关转换为ON开关(OFF状态→ON状态)。
研究团队成功利用控制Cas蛋白的生物工程技术,如split-Cas系统和anti-CRISPR蛋白,来操纵翻译许多不同的mRNA开关。
此外,该团队还测试了25种Cas蛋白,发现其中20种蛋白具有抑制翻译的功能,13种蛋白仅与其特定的mRNA对应物相互作用,这对于将它们组合用于构建人工遗传回路时至关重要。因此,这种方法极大地增加了可用mRNA开关的多样性。
借助这个扩展工具包,科学家们构建了各种复杂的人工电路,例如平移逻辑与门和多层级联。他们还利用Cas蛋白的转录和翻译控制,在哺乳动物细胞中设计了一个复杂的半减法运算电路。
通过极大地扩展可用于翻译调控的分子工具包,研究团队希望这项工作不仅能激发基于RNA和RBP的合成生物学应用,还能推动基因组编辑技术和CRISPR研究的未来发展,CARTRIDGE正是基于这些技术构建的。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。










