一个简单的纸测试可以提供早期癌症诊断
麻省理工学院的工程师设计了一种 新型纳米颗粒传感器 ,可以通过简单的尿液检测实现癌症的早期诊断。这些传感器可以检测许多不同的致癌蛋白,还可以用来区分肿瘤的类型或肿瘤对治疗的反应。
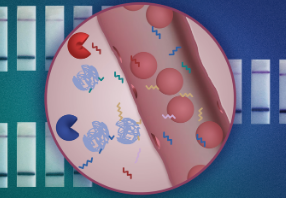
纳米颗粒被设计成当它们遇到肿瘤时,它们会脱落短的 DNA 序列,并通过尿液排出。分析这些 DNA“条形码”可以揭示特定患者肿瘤的显着特征。研究人员设计了他们的测试,以便可以使用一张纸条进行测试,类似于在家进行 Covid 测试,他们希望这种测试可以让尽可能多的患者负担得起并可以使用。
“我们正努力在使技术适用于中低资源环境的背景下进行创新。将这种诊断记录在纸上是我们实现诊断民主化和创造廉价技术的目标的一部分,这些技术可以在护理点为您提供快速答案,”约翰和多萝西威尔逊健康科学与技术和电气工程教授 Sangeeta Bhatia 说麻省理工学院计算机科学专业,麻省理工学院科赫综合癌症研究所和医学工程与科学研究所的成员。
在对老鼠的测试中,研究人员表明他们可以使用传感器来检测肿瘤中表达的五种不同酶的活性。他们还表明,他们的方法可以扩大到在单个样本中区分至少 46 种不同的 DNA 条形码,使用微流体设备来分析样本。
Bhatia 是该论文的高级作者 ,该论文今天发表在 Nature Nanotechnology上。现任波士顿大学生物医学工程助理教授的前麻省理工学院研究科学家郝亮亮是该研究的主要作者。
DNA条形码
几年来,Bhatia 的实验室一直在开发可用于诊断癌症的“合成生物标志物”。这项工作建立在检测患者血液样本中癌症生物标志物(例如蛋白质或循环肿瘤细胞)的概念之上。这些天然存在的生物标志物非常罕见,几乎不可能找到它们,尤其是在早期阶段,但合成生物标志物可用于放大小肿瘤内发生的小规模变化。
在之前的工作中,巴蒂亚 创造了 可以检测蛋白酶活性的纳米颗粒,蛋白酶通过切割细胞外基质的蛋白质帮助癌细胞逃离原来的位置,或定居到新的位置。纳米颗粒上涂有被不同蛋白酶切割的肽,一旦这些肽释放到血液中,它们就可以被浓缩并更容易在尿液样本中检测到。
最初的肽生物标志物被设计为使用质谱仪根据其质量的微小工程变化进行检测。这种设备在资源匮乏的环境中可能无法获得,因此研究人员着手开发可以更轻松、更经济地分析的传感器,使用可以使用 CRISPR 技术读取的 DNA 条形码。
为了使这种方法起作用,研究人员必须使用一种称为硫代磷酸酯的化学修饰来保护循环的 DNA 报告基因条形码不在血液中被分解。这种修饰已经被用于提高现代 RNA 疫苗的稳定性,使它们在体内存活更长时间。
与肽报告基因类似,每个 DNA 条形码都通过一个可以被特定蛋白酶切割的接头连接到一个纳米颗粒上。如果存在这种蛋白酶,DNA 分子就会被释放并自由循环,最终进入尿液。在这项研究中,研究人员使用了两种不同类型的纳米粒子:一种是由 FDA 批准用于人类的聚合物制成的粒子,另一种是“纳米抗体”——一种抗体片段,可以设计成在一定时间内积累肿瘤部位。
一旦传感器被分泌到尿液中,就可以使用纸条对样本进行分析,纸条可以识别被称为 Cas12a 的 CRISPR 酶激活的报告基因。当样品中存在特定的 DNA 条形码时,Cas12a 会放大信号,使其在纸质测试中显示为黑色条带。
这些颗粒可以设计成携带许多不同的 DNA 条形码,每个条形码检测一种不同类型的蛋白酶活性,从而允许“多重”传感。使用更多的传感器可以提高灵敏度和特异性,使测试更容易区分肿瘤类型。
疾病特征
在对小鼠进行的测试中,研究人员表明一组五个 DNA 条形码可以准确地区分首先出现在肺部的肿瘤和由转移到肺部的结直肠癌细胞形成的肿瘤。
“我们的目标是建立疾病特征,看看我们是否可以使用这些带条形码的面板,不仅可以读出疾病,还可以对疾病进行分类或区分不同的癌症类型,”Hao 说。
对于人类使用,研究人员预计他们可能需要使用五个以上的条形码,因为患者肿瘤之间的差异很大。为了帮助实现这一目标,他们与哈佛大学教授 Pardis Sabeti 领导的麻省理工学院布罗德研究所和哈佛大学的研究人员合作,创建了一种微流控芯片,可用于从一个样本中读取多达 46 种不同的 DNA 条形码。
这种测试不仅可以用于检测癌症,还可以用于测量患者的肿瘤对治疗的反应情况以及治疗后是否复发。研究人员现在正致力于进一步开发这些粒子,目的是在人体中对其进行测试。Glympse Bio 是一家由 Bhatia 共同创立的公司,已经对早期版本的尿液诊断颗粒进行了 1 期临床试验,发现它们对患者是安全的。
除了 Bhatia、Hao 和 Sabeti,该研究的合著者还包括 Renee T. Zhao、Nicole L. Welch、Edward Kah Wei Tan、Qian Zhong、Nour Saida Harzallah、Chayanon Ngambenjawong、Henry Ko 和 Heather E. Fleming。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。










